Diese Bestellung enthält Arzneimittel der Liste D.
Dieses Medikament darf gemäss dem schweizerischen Heilmittelgesetz nur auf Rezept versandt werden oder Sie können es ganz bequem über Pick me up reservieren und rezeptfrei in der Drogerie/Apotheke abholen. Dies ist ein zugelassenes Arzneimittel. Lesen Sie die Packungsbeilage. Bei Arzneimitteln ohne Packungsbeilage: Lesen Sie die Angaben auf der Packung.
Beschreibung
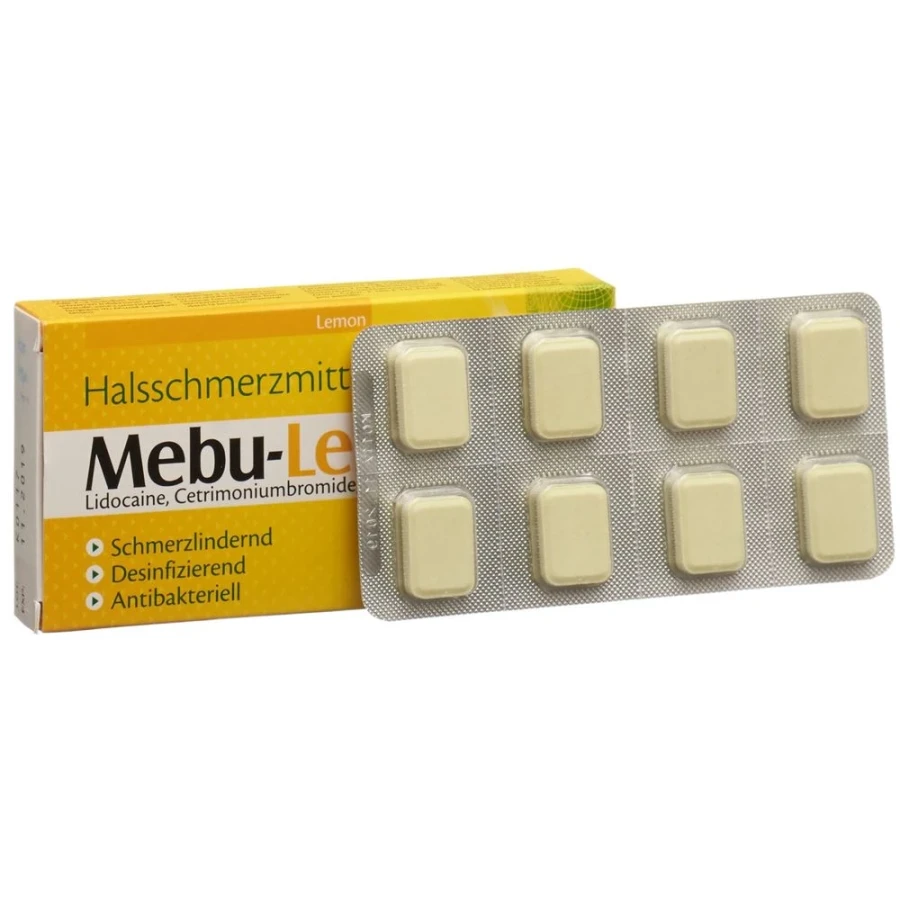
MEBU-LEMON Lutschtabl 24 Stk
Swissmedic-genehmigte Fachinformation
Mebu-Cherry, Mebu-Lemon, Lutschtabletten
Zusammensetzung
Wirkstoffe
Tyrothricin, Cetrimoniumbromid und Lidocain.
Hilfsstoffe
Mebu-Cherry: Sorbitol (E 420) 1.05 g, Guar Galactomannan, Citronensäure, Talkum, Povidon K25, Saccharin-Natrium, Magnesiumstearat, rotes Eisenoxid (E 172), Kirschenaroma (enthält Zimtaldehyd, Citral, Eugenol und Geraniol).
1 Lutschtablette enthält 0.7 mg (0.03 mmol) Natrium.
Mebu-Lemon: Sorbitol (E 420) 1.09 g, Citronensäure, Talkum, Zitronenaroma (enthält Butylhydroxyanisol [E 320], Citral, Sorbitol [E 420]), Guar Galactomannan, Magnesiumstearat, hochdisperses Siliciumdioxid, Saccharin-Natrium, Pfefferminzaroma, Chinolingelb (E 104), Indigotin (E 132), Aluminiumhydroxid.
1 Lutschtablette enthält 0.2 mg (0.01 mmol) Natrium.
Darreichungsform und Wirkstoffmenge pro Einheit
1 Lutschtablette enthält: 4 mg Tyrothricin, 2 mg Cetrimoniumbromid und 1 mg Lidocain.
Mebu-Cherry: pinkfarbene bis rote, weiss gesprenkelte Lutschtabletten, viereckig mit beidseitig abgeschliffenen Kanten, mit Kirschengeschmack.
Mebu-Lemon: leicht gelblich bis grünlich, gesprenkelte Lutschtabletten, rechteckig mit beidseitig abgeschliffenen Kanten, mit Zitronengeschmack.
Indikationen/Anwendungsmöglichkeiten
Entzündungen des Mund- und Rachenraumes, symptomatische Behandlung bei Halsschmerzen, Schluckweh, Stomatitis, Pharyngitis, Parodontitis, Gingivitis, Aphthen.
Dosierung/Anwendung
Die Lutschtabletten weder zerkauen noch ganz schlucken.
Die empfohlene Dosierung darf nicht überschritten werden.
Es sollte immer die niedrigste wirksame Dosis über die kürzest mögliche Zeitdauer verwendet werden.
Erwachsene
Alle 1-3 Stunden 1 Lutschtablette. Eine Tagesgesamtdosis von 8 Lutschtabletten sollte nicht überschritten werden.
Kinder und Jugendliche
Die Anwendung und Sicherheit von Mebu-Cherry bzw. Mebu-Lemon bei Kindern und Jugendlichen ist bisher nicht geprüft worden.
Art der Anwendung
Zur Anwendung in der Mundhöhle.
Mebu-Cherry bzw. Mebu-Lemon gegen Halsschmerzen beim Lutschen langsam im Mund bewegen, nicht in der Backentasche zergehen lassen.
Bei schweren Halsentzündungen oder Halsschmerzen, die mit hohem Fieber, Kopfschmerzen, Übelkeit oder Erbrechen einhergehen, nicht länger als 2 Tage ohne ärztlichen Rat anwenden.
Bei Aphthen die Lutschtablette im direkten Kontakt mit der Läsion langsam zergehen lassen.
Kontraindikationen
Überempfindlichkeit gegenüber Tyrothricin, Cetrimoniumbromid, Lidocain oder anderen Lokalanästhetika des Amidtyps. Überempfindlichkeit gegenüber einem der Hilfsstoffe gemäss Zusammensetzung.
Warnhinweise und Vorsichtsmassnahmen
Patienten sollten angewiesen werden einen Arzt, Apotheker bzw. eine Ärztin, Apothekerin aufzusuchen, falls die Halsschmerzen mit hohem Fieber, Schwindel und Erbrechen einhergehen, wenn starke Beschwerden beim Schlucken bestehen, sich die Symptome nicht bessern oder länger als 5-7 Tage anhalten. Mebu-Cherry bzw. Mebu-Lemon ist zur kurzfristigen Anwendung während 5-7 Tagen bestimmt.
Mebu-Cherry bzw. Mebu-Lemon sollte nicht während oder unmittelbar vor dem Trinken oder Essen angewendet werden. Die lokalanästhetische Wirkung des Lidocains kann ein vorübergehendes Taubheitsgefühl von Zunge und Rachen verursachen und so das Schlucken beeinträchtigen.
Mebu-Cherry bzw. Mebu-Lemon sollte bei Wunden und Verletzungen der Mund- und Rachenschleimhaut nur mit Vorsicht angewendet werden.
Nicht gleichzeitig mit anionischen Substanzen, wie z.B. Zahnpasten anwenden. Anionische Substanzen können die Wirkung von Cetrimonium verringern. Daher sollten die Lutschtabletten nicht unmittelbar vor oder nach dem Zähneputzen angewendet werden.
Die Anwendung von Antibiotika kann zu einem Überwuchern von unempfindlichen Keimen führen. Über pseudomembranöse Kolitis, von leichtem bis lebensbedrohlichem Schweregrad ist allgemein nach Anwendung von Antibiotika berichtet worden (in Einzelfällen auch nach Tyrothricin). Deshalb ist es wichtig, bei Patienten, die während oder nach Anwendung von Mebu-Cherry bzw. Mebu-Lemon Durchfall haben, die Diagnose zu prüfen.
In folgenden Fällen muss die Behandlung mit Mebu-Cherry bzw. Mebu-Lemon beendet und überprüft werden:
- wenn während der Therapie eine neue Infektion mit Bakterien oder Pilze auftritt
- bei anhaltendem oder stärkerem Durchfall oder bei Bauchkrämpfen.
Hilfsstoffe
Mebu-Cherry bzw. Mebu-Lemon enthält ca. 1 g Sorbitol (E 420) pro Lutschtablette. Die additive Wirkung gleichzeitig angewendeter Sorbitol (oder Fructose) -haltiger Arzneimittel und die Einnahme von Sorbitol (oder Fructose) über die Nahrung ist zu berücksichtigen. Der Sorbitolgehalt oral angewendeter Arzneimittel kann die Bioverfügbarkeit von anderen gleichzeitig oral angewendeten Arzneimitteln beeinflussen. Sorbitol ist eine Quelle für Fructose. Patienten mit hereditärer Fructose-Intoleranz (HFI) dürfen dieses Arzneimittel nicht anwenden.
Sorbitol kann Magen-Darm-Beschwerden hervorrufen und kann eine leicht abführende Wirkung haben.
Mebu-Cherry bzw. Mebu-Lemon enthält weniger als 1 mmol Natrium (23 mg) pro Lutschtablette, d.h. es ist nahezu «natriumfrei».
Mebu-Cherry enthält einen Duftstoff mit Zimtaldehyd, Citral, Eugenol und Geraniol. Zimtaldehyd, Citral, Eugenol und Geraniol können allergische Reaktionen hervorrufen. Zusätzlich zu allergischen Reaktionen bei sensibilisierten Patienten können nicht-sensibilisierte Patienten sensibilisiert werden.
Mebu-Lemon enthält Butylhydroxyanisol (E 320), welches örtlich begrenzt Hautreizungen (z.B. Kontaktdermatitis), Reizungen der Augen und der Schleimhäute hervorrufen kann.
Mebu-Lemon enthält einen Duftstoff mit Citral. Citral kann allergische Reaktionen hervorrufen. Zusätzlich zu allergischen Reaktionen bei sensibilisierten Patienten können nicht-sensibilisierte Patienten sensibilisiert werden.
Interaktionen
Es wurden keine Interaktionsstudien durchgeführt.
Tyrothricin: Da der Wirkstoff nicht aus dem Gastrointestinaltrakt absorbiert wird, sind keine systemischen Interaktionen zu erwarten.
Cetrimoniumbromid: Da der Wirkstoff kaum aus dem Gastrointestinaltrakt absorbiert wird, sind keine systemischen Interaktionen zu erwarten. Die Wirkung von Cetrimoniumbromid kann durch gleichzeitig applizierte anionische Tenside (z.B. Zahnpaste) verringert werden.
Lidocain: Theoretisch könnte Lidocain mit gleichzeitig verabreichten Arzneimitteln, wie z.B. mit anderen Antiarrhythmika interagieren; aufgrund der sehr geringen Mengen im Präparat sind keine Interaktionen zu erwarten.
Schwangerschaft/Stillzeit
Schwangerschaft
Lidocain passiert die Placenta. Hinweise auf fetale Risiken liegen nicht vor. Es liegen jedoch keine klinischen Daten mit Anwendung bei Schwangeren vor.
Bei der Anwendung in der Schwangerschaft ist Vorsicht geboten. Mebu-Cherry bzw. Mebu-Lemon soll während der Schwangerschaft nur angewendet werden, wenn es eindeutig erforderlich ist.
Stillzeit
Kleine Mengen von Lidocain werden in die Muttermilch ausgeschieden. Die in der Muttermilch zu erwartenden Wirkstoffkonzentrationen von Lidocain sind bei therapeutischer Dosierung so gering, dass Risiken für das Neugeborene als unwahrscheinlich beurteilt werden.
Da für Tyrothricin und Cetrimoniumbromid keine adäquaten Daten verfügbar sind, wird die Anwendung von Mebu-Cherry bzw. Mebu-Lemon während der Stillzeit nicht empfohlen.
Wirkung auf die Fahrtüchtigkeit und auf das Bedienen von Maschinen
Es wurden keine entsprechenden Studien durchgeführt.
Unerwünschte Wirkungen
Nachfolgend werden die unerwünschten Wirkungen, nach Systemorganklasse und Häufigkeiten geordnet, aufgelistet. Häufigkeiten werden folgendermassen definiert: sehr häufig (≥1/10), häufig (≥1/100 bis <1/10); gelegentlich (≥1/1000 bis <1/100), selten (≥1/10'000 bis <1/1000), sehr selten (<1/10'000). Innerhalb der einzelnen Häufigkeitsgruppen sind die unerwünschten Wirkungen nach absteigendem Schweregrad geordnet.
Erkrankung des Immunsystems
Selten: systemische Überempfindlichkeitsreaktionen.
Erkrankung des Gastrointestinaltrakts
Nausea kann auftreten, wenn das in den Lutschtabletten enthaltene Lidocain in hohen Dosen auf nüchternen Magen eingenommen wird.
Erkrankung der Haut und des Unterhautgewebes
Sehr selten: Hautausschlag, Pruritus.
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufige, fortgesetzte Verabreichung über längere Zeiträume kann lokale Reizungen verursachen. Die Anwendung von Tyrothricin auf frischen Wunden kann zu Blutungen führen.
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von grosser Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdacht einer neuen oder schwerwiegenden Nebenwirkung über das Online-Portal ElViS (Electronic Vigilance System) anzuzeigen. Informationen dazu finden Sie unter www.swissmedic.ch.
Überdosierung
Anzeichen und Symptome
Tyrothricin: Tyrothricin wird nach peroraler Aufnahme kaum resorbiert, weshalb eine Überdosierung als klinisch unbedeutend erachtet wird.
Cetrimoniumbromid: Wie bei allen quaternären Ammoniumverbindungen, kann die akzidentelle Einnahme einer grösseren Menge von Cetrimoniumbromid Übelkeit und Erbrechen verursachen. Bei den in Mebu-Cherry bzw. Mebu-Lemon Lutschtabletten enthaltenen Mengen Cetrimoniumbromid (quartäre Ammoniumbase) sind Curare artige Effekte am Nervensystem nicht zu erwarten. Eine symptomatische Therapie ist angezeigt; falls angebracht, sollten reizlindernde Mittel gegeben werden; induziertes Erbrechen und Magenspülung sollten vermieden werden. Die sofortige Gabe von Milch oder geschlagenem Eiweiss in Wasser wird empfohlen. Alkohol, welcher die Resorption begünstigt, ist zu vermeiden.
Lidocain: Lidocain wird gut resorbiert, aber auch rasch abgebaut. Schädliche Effekte auf das Zentralnervensystem und das Herz-Kreislauf-System sind bei Überdosierung aber nicht auszuschliessen. Der Patient ist im Falle einer möglichen Überdosierung sorgfältig zu beobachten. Bei Vergiftungserscheinungen sind die üblichen symptomatischen Behandlungsmassnahmen zu ergreifen.
Behandlung
Die Behandlung einer Überdosierung erfolgt symptomatisch und umfasst unterstützende Massnahmen je nach klinischen Symptomen oder gemäss den Empfehlungen von Tox Info Suisse.
Eigenschaften/Wirkungen
ATC-Code
R02AB02
Wirkungsmechanismus
Mebu-Cherry bzw. Mebu-Lemon dient zur lokalen Behandlung von Entzündungen im Mund- und Rachenbereich.
Tyrothricin ist ein typisches Antibiotikum mit bakteriostatischer Wirkung auf grampositive Bakterien. Eine Resistenzbildung oder Kreuzresistenzen mit anderen Antibiotika sind nicht bekannt. Die Möglichkeit einer Sensibilisierung ist gering.
Die antibakterielle Wirkung von Tyrothricin wird ergänzt durch die desinfizierende Wirkung von Cetrimoniumbromid. Letzteres besitzt eine leichte Oberflächenaktivität, welche ermöglicht, dass der antibakterielle und desinfizierende Effekt bis in die Tiefe des Gewebes dringt.
Lidocain ist ein Lokalanästhetikum vom Amidtyp. Es mindert aufgrund seiner lokalanästhetischen Wirkung die Hals- und Schluckbeschwerden, die mit der Infektion einhergehen.
Pharmakodynamik
Nicht zutreffend.
Klinische Wirksamkeit
Nicht zutreffend.
Pharmakokinetik
Absorption
Tyrothricin wird nicht absorbiert.
Cetrimoniumbromid wird kaum aus dem Gastrointestinaltrakt absorbiert.
Lidocain wird gut aus dem Gastrointestinaltrakt, über Schleimhäute und verletzte Haut absorbiert.
Distribution
Nicht zutreffend.
Metabolismus
Das nach oraler Verabreichung absorbierte Lidocain unterliegt in der Leber einem First-Pass-Metabolismus. Nach oraler Verabreichung beträgt seine Bioverfügbarkeit etwa 35%.
Elimination
Cetrimoniumbromid wird unverändert mit den Fäzes und im Urin ausgeschieden.
Die Metaboliten von Lidocain werden im Urin ausgeschieden, davon weniger als 10% in unveränderter Form.
Präklinische Daten
Keine für die Anwendung relevanten Präparate spezifischen Daten verfügbar.
Sonstige Hinweise
Haltbarkeit
Das Arzneimittel darf nur bis zu dem auf der Packung mit «EXP» bezeichneten Datum verwendet werden.
Besondere Lagerungshinweise
Bei Raumtemperatur (15–25 °C) und vor Licht und Feuchtigkeit geschützt lagern.
Für Kinder unerreichbar aufbewahren.
Zulassungsnummer
62301, 62302 (Swissmedic).
Zulassungsinhaberin
Spirig HealthCare AG, 4622 Egerkingen.
Stand der Information
Februar 2023.
Eigenschaften
| Art. Nr. | 05377643 |
| EAN Nr. | 7680623020017 |